पाठ के दिए गए प्रश्नोत्तर
1.1 to 1.40
Class 11
Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता
प्रश्न 1.
आवर्त सारणी में व्यवस्था का भौतिक आधार क्या है?
उत्तर
आवर्त सारणी में व्यवस्था का भौतिक आधार समान गुणधर्म (भौतिक तथा रासायनिक गुण) वाले तत्वों को एकसाथ एक ही वर्ग में रखना है। चूंकि तत्वों के ये गुणधर्म मुख्यत: उनके संयोजी कोश के इलेक्ट्रॉनिक विन्यास पर निर्भर करते हैं। अत: किसी समूह के तत्वों के परमाणुओं के संयोजी कोश विन्यास समान होते हैं।
 |
NCERT Solutions for Class 11 Maths Chapter 1 Sets in Hindi-RDS TEAM |
प्रश्न 2.
मेंडलीव ने किस महत्त्वपूर्ण गुणधर्म को अपनी आवर्त सारणी में तत्वों के वर्गीकरण का आधार बनाया? क्या वे उस पर दृढ़ रह पाए?
उत्तर
मेंडलीव ने परमाणु भार को, तत्त्वों के वर्गीकरण का आधार माना तथा तत्त्वों को बढ़ते हुए परमाणु भार के क्रम में व्यवस्थित किया। वह अपने आधार पर निष्ठापूर्वक दृढ़ रहे तथा उन्होंने उन तत्त्वों के लिए रिक्त स्थान छोड़ा जो उस समय ज्ञात नहीं थे तथा उनके परमाणु भारों के आधार पर, उनके लक्षणों या गुणों की भविष्यवाणी की। उनकी भविष्यवाणियाँ उन तत्त्वों की खोज होने पर सत्य पायी गयीं।
प्रश्न 3.
मेंडलीव के आवर्त नियम और आधुनिक आवर्त नियम में मौलिक अन्तर क्या है?
उत्तर
मेंडलीव का आवर्त नियम तत्त्वों के परमाणु भारों पर आधारित है, जबकि आधुनिक आवर्त नियम तत्त्वों के परमाणु क्रमांकों पर आधारित है। इस प्रकार मौलिक अन्तर वर्गीकरण का आधार है।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 4.
क्वाण्टम संख्याओं के आधार पर यह सिद्ध कीजिए कि आवर्त सारणी के छठवें आवर्त में 32 तत्व होने चाहिए।
उत्तर
आवर्त सारणी के दीर्घ रूप में प्रत्येक आवर्त एक नई कक्षा के भरने से प्रारम्भ होता है। छठवाँ आवर्त (मुख्य क्वाण्टम संख्या = 6)n = 6 से प्रारम्भ होता है। इस कक्ष के लिए, n= 6 तथा != 0,1, 2 तथा 3 होगा (उच्च मान आदेशित नहीं है)।
इस प्रकार, उपकक्षाएँ 6s, 6p, 6d तथा 6 इलेक्ट्रॉनों के समावेशन के लिए उपलब्ध हैं। किन्तु आँफबाऊ के नियमानुसार 6d तथा 6/-उपकक्षाओं की ऊर्जा 7s-उपकक्षाओं की तुलना में अधिक होती है। इसलिए यह कक्षाएँ 7s उपकक्षाओं के भरने तक नहीं भरती हैं। इसके अतिरिक्त 5d- तथा 4- उपकक्षाओं की ऊर्जाएँ 6p- उपकक्षाओं से कम होती हैं। इसलिए, छठवें आवर्त में, इलेक्ट्रॉन्स केवल 6s, 4,5d तथा 6p- उपकक्षाओं में भरते हैं। इन उपकक्षाओं में इलेक्ट्रॉन्स की संख्याएँ क्रमशः 2, 14, 10 तथा 6 होती हैं अर्थात् कुल 32 इलेक्ट्रॉन्स होते हैं। इसी कारण छठवें आवर्त में 32 तत्त्व होते।
प्रश्न 5.
आवर्त और वर्ग के पदों में यह बताइए कि z = 14 कहाँ स्थित होगा?
उत्तर
z=114 तत्त्व का इलेक्ट्रॉनिक विन्यास निम्न है-
![]()
यह स्पष्ट है कि दिया तत्त्व एक सामान्य तत्त्व है तथा आवर्त सारणी के p-ब्लॉक से सम्बन्धित है।’ चूँकि इस तत्त्व में n = 7 कक्ष में इलेक्ट्रॉन उपस्थित हैं, अत: यह आवर्त सारणी के सातवें आवर्त में स्थित होगा। इसके अतिरिक्त समूह की संख्या = 10+ संयोजी इलेक्ट्रॉनों की संख्या
= 10 +4 = 14
अतः दिया गया तत्त्व सातवें आवर्त में तथा समूह 14 में स्थित है।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 6.
उस तत्व का परमाणु क्रमांक लिखिए, जो आवर्त सारणी में तीसरे आवर्त और 17वें वर्ग में स्थित होता है।
उत्तर
तीसरे आवर्त में केवल 3- तथा 3p-कक्षाएँ भरती हैं। अत: आवर्त में केवल दो – तथा छः p-ब्लॉक के तत्त्व होते हैं। तीसरा आवर्त Z=11 से प्रारम्भ होकर Z= 18 पर समाप्त होता है। अतः Z=11 तथा Z= 12 के तत्त्व -ब्लॉक में स्थित होंगे। अगले छः तत्त्व Z = 13 (समूह 13) से Z= 18 (समूह 18)p-ब्लॉक के तत्त्व हैं। इसलिए वह तत्त्व जो 17वें समूह में स्थित है उसका परमाणु क्रमांक Z = 17 होगा।
प्रश्न 7.
कौन-से तत्व का नाम निम्नलिखित द्वारा दिया गया है?
(i) लॉरेन्स बर्कले प्रयोगशाला द्वारा
(ii) सी बोर्ग समूह द्वारा।
उत्तर
- लॉरेन्सियम (Lawrencium) (Z=103) तथा बर्केलियम (Berkelium) (Z=97)
- सीबोर्गीयम (Seaborgium) (Z = 106)
प्रश्न 8.
एक ही वर्ग में उपस्थित तत्वों के भौतिक और रासायनिक गुणधर्म समान क्यों होते हैं?
उत्तर
एक ही वर्ग में उपस्थित तत्त्वों के इलेक्ट्रॉनिक विन्यास समान होते हैं अर्थात् उनकी संयोजी कक्षा में इलेक्ट्रॉनों की संख्या समान होती है। इसी कारण से एक ही वर्ग में उपस्थित तत्त्वों के भौतिक तथा रासायनिक गुणधर्म समान होते हैं।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 9.
परमाणु त्रिज्या’ और ‘आयनिक त्रिज्या से आप क्या समझते हैं?
उत्तर
परमाणु त्रिज्या से तात्पर्य परमाणु का आकार है, जो परमाणु के नाभिक के केन्द्र से बाह्यतम कक्षा के इलेक्ट्रॉन की दूरी के बराबर मानी जाती है। किसी आयन की ‘आयनिक त्रिज्या’ उसके नाभिक तथा उस बिन्दु के मध्य की दूरी को माना जाता है जिस पर नाभिक का प्रभाव आयन के इलेक्ट्रॉन मेघ पर प्रभावी होता है।
प्रश्न 10.
किसी वर्ग या आवर्त में परमाणु त्रिज्या किस प्रकार परिवर्तित होती है? इस परिवर्तन की व्याख्या आप किस प्रकार करेंगे?
उत्तर
आवर्त में परमाणु त्रिज्याएँ (Atomic Radii in Periods) किसी आवर्त में बाएँ से दाएँ चलने पर परमाणु त्रिज्याएँ नियमित क्रम में क्षार धातु से हैलोजेन तक घटती हैं; क्योंकि नाभिकीय आवेश बढ़ने के साथ-साथ बाह्यतम कोश के इलेक्ट्रॉनों की संख्या भी बढ़ती है, फलस्वरूप बाह्यतम कोश के इलेक्ट्रॉनों को आकर्षित करने की क्षमता भी बढ़ती है। इस कारण इनकी नाभिक व बाह्यतमं कोशों के बीच की दूरी क्रमशः घटती है; अत: परमाणु त्रिज्या घटती है। (यह ध्यान देने योग्य है कि यहाँ उत्कृष्ट गैसों की परमाणु त्रिज्या पर विचार नहीं किया जा रहा है। एकल परमाणु होने के कारण उनकी आबन्धित त्रिज्या बहुत अधिक है। इसलिए उत्कृष्ट गैसों की तुलना दूसरे तत्वों की सहसंयोजक त्रिज्या से न करके वाण्डरवाल्स त्रिज्या से करते हैं।)
कुछ तत्वों के लिए परमाणु त्रिज्या का मान निम्नांकित सारणी-1 में दिया गया है-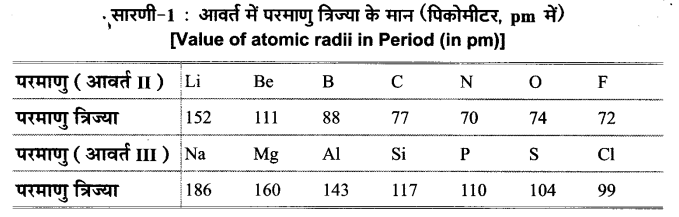
द्वितीय आवर्त में परमाणु त्रिज्या में परमाणु क्रमांक के साथ परिवर्तन चित्र-1 में प्रदर्शित वक्र द्वारा और अधिक स्पष्ट होता है। वक्र में स्पष्ट प्रदर्शित है कि नितान्त बाईं ओर स्थित क्षार धातु (Li) की परमाणु त्रिज्या अधिकतम तथा नितान्त दाईं ओर स्थित हैलोजेन (F) की परमाणु त्रिज्या का मान न्यूनतम है।
वर्ग में परमाणु त्रिज्याएँ (Atomic radii in Groups)
किसी वर्ग में ऊपर से नीचे चलने पर परमाणु त्रिज्याएँ बढ़ती हैं; क्योंकि जैसे-जैसे नाभिकीय आवेश बढ़ता है, इलेक्ट्रॉनिक कोशों की संख्या बढ़ती जाती है, फलस्वरूप बाह्यतम कोश के इलेक्ट्रॉनों को आकर्षित करने की क्षमता घटती है; अत: परमाणु त्रिज्या बढ़ती है।
निम्नांकित सारणी-2 में धातुओं तथा हैलोजेन तत्वों के लिए परमाणु त्रिज्याएँ दी गई हैं

वर्ग में परमाणु क्रमांकों के साथ क्षार धातुओं तथा हैलोजेनों की परमाणु त्रिज्याओं में परिवर्तन चित्र-2 में प्रदर्शित वक्र द्वारा और अधिक स्पष्ट होता है। मानों से यह स्पष्ट है कि लीथियम (Li) की परमाणु त्रिज्या न्यूनतम तथा सीजियम (Cs) की अधिकतम है। इसी प्रकार हैलोजेनों में फ्लुओरीन (F) की परमाणु त्रिज्या न्यूनतम तथा आयोडीन (I) की अधिकतम है।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 11.
समइलेक्ट्रॉनिक स्पीशीज से आप क्या समझते हैं? एक ऐसी स्पीशीज का नाम लिखिए, जो निम्नलिखित परमाणुओं या आयनों के साथ समइलेक्ट्रॉनिक होगी-
(i) F
(ii) Ar
(iii) Mg2+
(iv) Rb+
उत्तर
वे स्पीशीज (विभिन्न तत्त्वों के आयन या परमाणु) जिनमें इलेक्ट्रॉनों की संख्या समने होती है। लेकिन नाभिकीय आवेश भिन्न होता है, समइलेक्ट्रॉनिक स्पीशीज कहलाती हैं।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 12.
निम्नलिखित स्पीशीज पर विचार कीजिए- –
N3-,O2-, F–, Na+, Mg2+ तथा Al3+
(क) इनमें क्या समानता है? |
(ख) इन्हें आयनिक त्रिज्या के बढ़ते क्रम में व्यवस्थित कीजिए।
उत्तर
(क) दी गई प्रत्येक स्पीशीज में 10 इलेक्ट्रॉन हैं। अत: ये सब समइलेक्ट्रॉनिक स्पीशीज हैं।
(ख) समइलेक्ट्रॉनिक आयनों की आयनिक त्रिज्या, परमाणु आवेश के बढ़ने के साथ घटती है। दी।
प्रश्न 13.
धनायन अपने जनक परमाणुओं से छोटे क्यों होते हैं और ऋणायनों की त्रिज्या उनके जनक परमाणुओं की त्रिज्या से अधिक क्यों होती है? व्याख्या कीजिए।
उत्तर
जनक परमाणुओं से एक या अधिक इलेक्ट्रॉनों के निकलने पर प्रभावी नाभिकीय आवेश बढ़ता है। इस प्रकार बचे हुए इलेक्ट्रॉन अधिक नाभिकीय आकर्षण का अनुभव करते हैं। परिणामस्वरूप त्रिज्या घटती है। इसी कारण धनायन की त्रिज्या उनके जनक परमाणु से छोटी होती है। दूसरी ओर, जनके परमाणुओं में एक या अधिक इलेक्ट्रॉन बढ़ने पर प्रभावी नाभिकीय आवेश घटता है। इस प्रकार, इलेक्ट्रॉन कम नाभिकीय आकर्षण या खिंचाव अनुभव करते हैं। परिणामस्वरूप त्रिज्या बढ़ती है। इसी कारण से ऋणायनों की त्रिज्या उनके जनक परमाणुओं की त्रिज्या से अधिक होती है।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 14.
आयनन एन्थैल्पी और इलेक्ट्रॉन लब्धि एन्थैल्पी को परिभाषित करने में विलगित गैसीय परमाणु तथा ‘आद्य अवस्था पदों की सार्थकता क्या है?
उत्तर
किसी परमाणु के नाभिक द्वारा उसमें उपस्थित इलेक्ट्रॉनों पर आरोपित बल काफी मात्रा में अणु में उपस्थित अन्य परमाणुओं तथा पड़ौसी परमाणुओं की उपस्थिति पर निर्भर करता है। चूंकि इस बल का परिमाण आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी के मानों को निर्धारित करता है, अतः इन्हें विलगित परमाणुओं के लिए परिभाषित करना आवश्यक है। एक अकेले परमाणु को विलगित करना सम्भव नहीं है। चूंकि गैसीय अवस्था में परमाणु (या अणु) काफी अलग होते हैं, आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी गैसीय परमाणुओं के लिए परिभाषित की जाती है तथा यह माना जाता है कि वे विलगित हैं। इसके अतिरिक्त आद्य अवस्था (ground state) निम्नतम ऊर्जा की अवस्था अर्थात् सबसे अधिक स्थाई अवस्था को निर्देशित करती है। यदि परमाणु उत्तेजित अवस्था में है, तो इसकी ऊर्जा का एक निश्चित मान होगा और इस अवस्था में आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी के मान भिन्न होंगे। अतः आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी को परिभाषित करते समय एक गैसीय परमाणु को आद्य अवस्था में स्थित होना आवश्यक है।
प्रश्न 15.
हाइड्रोजन परमाणु में आद्य अवस्था में इलेक्ट्रॉन की ऊर्जा -2.18 x 10-18 J है। परमाणविक हाइड्रोजन की आयनन एन्थैल्पी Jmol-1 के पदों में परिकलित कीजिए।
उत्तर
हाइड्रोजन परमाणु की आद्य अवस्था से इलेक्ट्रॉन निकालने के लिए आवश्यक ऊर्जा
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 16.
द्वितीय आवर्त के तत्वों में वास्तविक आयनन एन्थैल्पी का क्रम इस प्रकार है
Li< B < Be<C< O< N < F < Ne व्याख्या कीजिए कि
(i) Be की ∆i,H, B से अधिक क्यों है?
(ii) O की ∆iH, N और F से कम क्यों है?
उत्तर
(i) Be तथा B के इलेक्ट्रॉनिक विन्यास निम्नांकित प्रकार हैं
4Be= 2,2 या 1s2 ,2s2
5B= 2, 3 या 1s2 ,2s2 2p1
बोरॉन (B) में, इसके एक 2p कक्षक में एक अयुग्मित इलेक्ट्रॉन है। बेरिलियम (Be) में युग्मित : इलेक्ट्रॉनों वाले पूर्ण-पूरित ls तथा 25 कक्षक हैं।
जब हम एक ही मुख्य क्वाण्टम ऊर्जा स्तर पर विचार करते हैं तो 5-इलेक्ट्रॉन p-इलेक्ट्रॉन की तुलना में नाभिक की ओर अधिक आकर्षित होता है। बेरिलियम में बाह्यतम इलेक्ट्रॉन, जो अलग किया जाएगा, वह 5-इलेक्ट्रॉन होगा, जबकि बोरॉन में बाह्यतम इलेक्ट्रॉन (जो अलग किया जाएगा) p-इलेक्ट्रॉन होगा। उल्लेखनीय है कि नाभिक की ओर 2-इलेक्ट्रॉन का भेदन (penetration) 2p-इलेक्ट्रॉन की तुलना में अधिक होता है। इस प्रकार बोरॉन का 2p-इलेक्ट्रॉन बेरिलियम के 2-इलेक्ट्रॉन की तुलना में आन्तरिक क्रोड इलेक्ट्रॉनों द्वारा अधिक परिरक्षित होता है। चूंकि बेरिलियम के 25-इलेक्ट्रॉन की तुलना में बोरॉन को 2p-इलेक्ट्रॉन अधिक सरलता से पृथक् हो जाता है; अत: बेरिलियम की तुलना में बोरॉन की प्रथम आयनन एन्थैल्पी (∆iH) का मान कम होगा।
(ii) नाइट्रोजन तथा ऑक्सीजन के इलेक्ट्रॉनिक विन्यास निम्नांकित प्रकार हैं
7N = 2,5 या 1s2, 2s2 2p1x 2p1y 2p1z
8O= 2,6 या 1s2 , 2s2 2p2x 2p1y 2p1z
स्पष्ट है कि नाइट्रोजन में तीनों बाह्यतम 2p-इलेक्ट्रॉन विभिन्न p-कक्षकों में वितरित हैं (हुण्ड का नियम), जबकि ऑक्सीजन के चारों 2p-इलेक्ट्रॉनों में से दो 2p-इलेक्ट्रॉन एक ही 2p-ऑर्बिटल में हैं; फलतः इलेक्ट्रॉन प्रतिकर्षण बढ़ जाता है। फलस्वरूप नाइट्रोजन के तीनों 2p-इलेक्ट्रॉनों में से एक इलेक्ट्रॉन पृथक् करने की तुलना में ऑक्सीजन के चारों 2p-इलेक्ट्रॉनों में से चौथे इलेक्ट्रॉन को पृथक् करना सरल हो जाता है; अतः 6 की प्रथम आयनन एन्थैल्पी (∆iH) का मान N से कम होता है। यही स्पष्टीकरण F के लिए भी दिया जा सकता है।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 17.
आप इस तथ्य की व्याख्या किस प्रकार करेंगे कि सोडियम की प्रथम आयनन एन्थैल्पी मैग्नीशियम की प्रथम आयनन एन्थैल्पी से कम है, किन्तु इसकी द्वितीय आयनन एन्थैल्पी मैग्नीशियम की द्वितीय आयनन एन्थैल्पी से अधिक है?
उत्तर
Na तथा Mg के इलेक्ट्रॉनिक विन्यास निम्न हैं-
Na (Z= 11): 1s2 2s2 2p6 3s1
Mg (Z= 12): 1s2 2s2 2p6 3s2
चूँकि सोडियम (+11) ; में मैग्नीशियम’ (+12) की तुलना में कम नाभिकीय आवेश है, सोडियम की प्रथम आयनन एन्थैल्पी मैग्नीशियम की तुलना में कम होगी।
प्रथम इलेक्ट्रॉन निकलने के बाद, सोडियम Na+ आयन में परिवर्तित हो जाता है तथा मैग्नीशियम Mg+ में। इनका इलेक्ट्रॉनिक विन्यास निम्न प्रकार से होगा-
Na+ : 1s2 2s2 2p6
Mg+ : 1s2 2s2 2p6 3s1
Na+ आयन का इलेक्ट्रॉनिक विन्यास निऑन के समान एक बहुत अधिक स्थाई इलेक्ट्रॉनिक विन्यास , है। इसलिए Na+ आयन से Mg की तुलना में इलेक्ट्रॉन निकालने के लिए अधिक ऊर्जा की आवश्यकता होगी। इसी कारण से सोडियम की द्वितीय आयनन एन्थैल्पी, मैग्नीशियम की तुलना में अधिक होती है।
प्रश्न 18.
मुख्य समूह तत्वों में आयनन एन्थैल्पी के किसी समूह में नीचे की ओर कम होने के कौन-से कारक हैं?
उत्तर
मुख्य समूह तत्वों में आयनन एन्थैल्पी के किसी समूह में नीचे की ओर कम होने के विभिन्न कारक निम्नलिखित हैं-
- समूह में नीचे जाने पर नाभिकीय आवेश बढ़ता है।
- समूह में नीचे जाने पर प्रत्येक तत्व में नए कोश जुड़ जाने के कारण परमाणु आकार बढ़ जाते ।
- समूह में नीचे जाने पर आन्तरिक इलेक्ट्रॉनों की संख्या बढ़ जाती है। इससे बाह्यतम इलेक्ट्रॉनों पर आवरण-प्रभाव घट जाता है।
परमाणु आकार में वृद्धि तथा आवरण-प्रभाव का संयुक्त प्रभाव नाभिकीय आवेश में वृद्धि के प्रभाव से अधिक हो जाता है। ये प्रभाव इस प्रकार कार्य करते हैं कि नाभिक तथा बाह्यतम इलेक्ट्रॉनों के मध्य आकर्षण बल कम हो जाता है। परिणामस्वरूप समूह में नीचे जाने पर आयनन एन्थैल्पी कम हो जाती है।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 19.
वर्ग 13 के तत्वों की प्रथम आयनन एन्थैल्पी के मान (kJ mol-1) में इस प्रकार हैं-
उत्तर
सामान्य परम्परा के अनुसार वर्ग 13 में ऊपर से नीचे जाने पर आयनन एन्थैल्पी घटती है। लेकिन Ga तथा TI इसके अपवाद हैं। d तथा / इलेक्ट्रॉनों का परिरक्षण प्रभाव (shielding effect) 5 तथा 2 इलेक्ट्रॉनों की तुलना में कम होता है। Ga में 3d इलेक्ट्रॉन होते हैं, जबकि T1 में 5d तथा 47 इलेक्ट्रॉन होते हैं। कम परिरक्षण प्रभाव के कारण, Ga तथा T1 परमाणुओं के नाभिक संयोजी इलेक्ट्रॉन को मजबूती से बाँधे रखते हैं। इसी कारण से पड़ौसी तत्त्वों की तुलना में इनकी आयनन एन्थैल्पी अधिक होती है।
प्रश्न 20.
तत्वों के निम्नलिखित युग्मों में किस तत्व की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होगी?
(i) O या F
(ii) F या Cl
उत्तर
- F की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होगी। O से F तक जाने में, परमाणु आकार घटता है तथा नाभिकीय आवेश बढ़ता है। ये दोनों कारक फ्लुओरीन की इलेक्ट्रॉन लब्धि एन्थैल्पी के मान को अधिक ऋणात्मक बनाते हैं क्योंकि ये आने वाले इलेक्ट्रॉन के लिए नाभिकीय आकर्षण में वृद्धि करते हैं।
- CI की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होती है।

प्रश्न 21.
आप क्या सोचते हैं कि O की द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी प्रथम इलेक्ट्रॉन लब्धि एन्थैल्पी के समान धनात्मक, अधिक ऋणात्मक या कम ऋणात्मक होगी? अपने उत्तर की पुष्टि कीजिए।
उत्तर
ऑक्सीजन (O) की द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी धनात्मक होती है। उदासीन ऑक्सीजन परमाणु में प्रथम इलेक्ट्रॉन के जुड़ने पर ऊर्जा का निष्कासन होता है तथा प्रथम इलेक्ट्रॉन लब्धि एन्थैल्पी ऋणात्मक होती है।
O(g)+e– → O– (g); ∆eg H= -141.0 kJ
और अधिक इलेक्ट्रॉन के जुड़ने के लिए ऊर्जा का अवशोषण आवश्यक है।
O–(g)+e– → O2-(g); ∆egH = +780.0kJ
इसका कारण यह है कि ऋण आवेशित 0 आयन तथा आने वाले इलेक्ट्रॉन के बीच प्रबल विद्युत स्थैतिक प्रतिकर्षण होता है। इस स्थिति में इलेक्ट्रॉन को जोड़ने के लिए ऊर्जा का अवशोषण आवश्यक है जो विद्युत स्थैतिक प्रतिकर्षण पर विजय प्राप्त करता है। इसी कारण से ऑक्सीजन की द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी धनात्मक होती है।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 22.
इलेक्ट्रॉन लब्धि एन्थैल्पी और इलेक्ट्रॉन ऋणात्मकता में क्या मूल अन्तर है?
उत्तर
इलेक्ट्रॉन लब्धि एन्थैल्पी किसी विलगित गैसीय परमाणु की एक अतिरिक्त इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति को संदर्भित करती है, जबकि विद्युत ऋणात्मकता किसी परमाणु के द्वारा सहसंयोजक बध में साझे के युग्मित इलेक्ट्रॉन को अपनी ओर खींचने की प्रवृत्ति है। इस प्रकार ये दोनों गुण एक-दूसरे से बिल्कुल भिन्न हैं, जबकि दोनों एक परमाणु द्वारा इलेक्ट्रॉन को आकर्षित करने की प्रवृत्ति को संदर्भित करते हैं।
प्रश्न 23.
सभी नाइट्रोजन यौगिकों में N की विद्युत ऋणात्मकता पॉलिंग पैमाने पर 3.0 है। आप इस कथन पर अपनी क्या प्रतिक्रिया देंगे?
उत्तर
यह कथन विवादास्पद है क्योंकि एक परमाणु की विद्युत ऋणात्मकता उसके सभी यौगिकों में स्थिर नहीं होती है। यह संकरण अवस्था तथा ऑक्सीकरण अवस्था के साथ बदलती है। उदाहरण के लिए, NO, तथा NO में N की विद्युत ऋणात्मकता, ऑक्सीकरण अवस्थाओं में भिन्नता के कारण, भिन्न होती है।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 24.
उस सिद्धान्त का वर्णन कीजिए, जो परमाणु की त्रिज्या से सम्बन्धित होता है,
(i) जब वह इलेक्ट्रॉन प्राप्त करता है।
(ii) जब वह इलेक्ट्रॉन का त्याग करता है।
उत्तर
(i) जब परमाणु एक या अधिक इलेक्ट्रॉन प्राप्त करता है, तब ऋणायन बनता है। परमाणु के ऋणायन में परिवर्तन के दौरान एक या अधिक इलेक्ट्रॉन परमाणु के संयोजी कोश से जुड़ जाते हैं। नाभिकीय आवेश जनक परमाणु के समान ही रहता है। संयोजी कोश में इलेक्ट्रॉनों की संख्या में वृद्धि, इलेक्ट्रॉनों द्वारा परस्परीय परिरक्षण की अधिकता के कारण, प्रभावी नाभिकीय आवेश को कम कर देती है। परिणामस्वरूप इलेक्ट्रॉन-मेघ विस्तृत हो जाता है अर्थात् आयनिक त्रिज्या बढ़ जाती है।
(ii) जब परमाणु एक या अधिक इलेक्ट्रॉनों का त्याग करता है, तब धनायन बनता है। इस प्रकार प्राप्त धनायन सदैव अपने जनक परमाणु से आकार में छोटा होता है। ऐसा निम्नलिखित कारणों से हो सकता है-
- संयोजी कोश के विलोपन द्वारा (By elimination of valence shell)-कुछ स्थितियों में, इलेक्ट्रॉन त्यागने पर संयोजी कोश को पूर्णतया विलोपन हो जाता है। बाह्यतम कोश विलुप्त होने के कारण धनायन के आकार में कमी आ जाती है।
- प्रभावी नाभिकीय आवेश में वृद्धि के द्वारा (By increase in effective nuclear charge)-धनायन में, इलेक्ट्रॉनों की संख्या जनक परमाणु से कम होती है। कुल नाभिकीय आवेश समान रहता है। यह प्रभावी नाभिकीय आवेश को बढ़ा देता है। परिणामस्वरूप, इलेक्ट्रॉन नाभिक से अधिक दृढ़ता से जुड़े रहते हैं जिससे इनके आकार में कमी आ जाती है।
- Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM

प्रश्न 25.
किसी तत्व के दो समस्थानिकों की प्रथम आयनन एन्थैल्पी समान होगी या भिन्न? आप क्या मानते हैं? अपने उत्तर की पुष्टि कीजिए।
उत्तर
एक तत्त्व के समस्थानिकों में इलेक्ट्रॉनों की संख्या, परमाणु नाभिकीय आवेश तथा आकार समान होता है। इसलिए इनकी प्रथम आयनन एन्थैल्पी के मान समान होते हैं।
प्रश्न 26.
धातुओं और अधातुओं में मुख्य अन्तर क्या है?
उत्तर
धातुएँ विद्युत धनात्मक तत्त्व हैं तथा एक या अधिक संयोजी इलेक्ट्रॉनों को त्यागकर धनायनों का निर्माण करती हैं। ये एक अपचायक के रूप में कार्य करती हैं तथा इनकी आयनन एन्थैल्पी, इलेक्ट्रॉनिक लब्धि एन्थैल्पी तथा विद्युत ऋणात्मकता का मान कम होता है। ये बेसिक ऑक्साइड्स बनाती हैं। दूसरी तरफ, अधातुएँ विद्युत ऋणात्मक तत्त्व हैं तथा अपने संयोजी कक्ष में एक या अधिक इलेक्ट्रॉन ग्रहण कर ऋणायन बनाने की प्रवृत्ति दर्शाती हैं। ये ऑक्सीकारक के रूप में कार्य करती हैं। इनकी आयनन एन्थैल्पी, इलेक्ट्रॉन लब्धि एन्थैल्पी तथा विद्युत ऋणात्मकता के मान अधिक होते हैं। ये अम्लीय ऑक्साइड बनाती हैं।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 27.
आवर्त सारणी का उपयोग करते हुए निम्नलिखित प्रश्नों के उत्तर दीजिए
(क) उस तंव का नाम बताइए जिसके बाह्य उप-कोश में पाँच इलेक्ट्रॉन उपस्थित हों।
(ख) उस तत्व का नाम बताइए जिसकी प्रवृत्ति दो इलेक्ट्रॉनों को त्यागने की हो।
(ग) उस तत्व का नाम बताइए जिसकी प्रवृत्ति दो इलेक्ट्रॉनों को प्राप्त करने की हो।
(घ) उस वर्ग का नाम बताइए जिसमें सामान्य ताप पर धातु, अधातु, द्रव और गैस उपस्थित हों।
उत्तर
(क) F(1s2 2s2 2p5)
(ख) Mg (1s2 2s2 2p6 3s2); Mg → Mg2+ +2 e–
(ग) O(1s2 2s2 2p4); 0+2e– → 02-
(घ) द्रव धातुएँ : Hg (वर्ग 12) तथा Ga (वर्ग 13) हैं।
द्रव अधातुएँ ब्रोमीन (वर्ग 17) हैं। गैसीय अधातुएँ : फ्लुओरीन तथा क्लोरीन (वर्ग 17), ऑक्सीजन (वर्ग 16), नाइट्रोजन (वर्ग 15) इत्यादि।
प्रश्न 28.
प्रथम वर्ग के तत्वों के लिए अभिक्रियाशीलता का बढ़ता हुआ क्रम इस प्रकार है- Li < Na < K < Rb < Cs; जबकि वर्ग 17 के तत्वों में क्रम F > Cl> Br>I है।
इसकी व्याख्या कीजिए।
उत्तर
वर्ग 1 के तत्त्व विद्युत धनात्मक तत्त्व होते हैं तथा संयोजी इलेक्ट्रॉन को त्यागकर एकल धनात्मक धनायन बनाते हैं। इनकी क्रियाशीलता आयनन एन्थैल्पी के मान पर निर्भर करती है। यदि आयनन एन्थैल्पी का मान कम है तो क्रियाशीलता अधिक होती है। चूंकि वर्ग में नीचे जाने पर, आयनन एन्थैल्पी का मान घटता है, अतः प्रथम वर्ग के तत्त्वों की क्रियाशीलता वर्ग में नीचे जाने पर बढ़ती है। (अर्थात् इस क्रम में, Li Cl > Br> I)
प्रश्न 29.
S-, p-, d और f-ब्लॉक के तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर
(i) s-ब्लॉक तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास ns1-2 (अर्थात् ns1 या ns2) होता है।
(ii) p-ब्लॉक तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास ns2np1-6 होता है।
(iii) d-ब्लॉक तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास (n-1) d1-10 ns1-2 होता है।
(iv) f-ब्लॉक तत्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास (n-2) f1-14 (n-1) 4d0-1ns2 होता है।
प्रश्न 30.
तत्व, जिसका बाह्य इलेक्ट्रॉनिक विन्यास निम्नलिखित है, का स्थान आवर्त सारणी में बताइए-
(i) ns2np4, जिसके लिए n = 3 है।
(ii) (n-1) d2 ns2, जब n= 4 है तथा
(iii) (n-2)f7 (n-1) d1 ns2, जब n= 6 है।
उत्तर
(i) दिया गया तत्त्व तीसरे आवर्त (n=3) में उपस्थित है तथा इसके संयोजी कक्ष में 6(2+4) इलेक्ट्रॉन उपस्थित हैं। यह एक p-ब्लॉक तत्त्व है क्योंकि विभेदी (differentiating) इलेक्ट्रॉन p-उपकक्ष में प्रवेश करता है।
∴ वर्ग की संख्या = 10+ संयोजी इलेक्ट्रॉनों की संख्या = 10+6= 16
इस प्रकार, यह तत्त्व तीसरे आवर्त तथा वर्ग 16 में स्थित है। यह सल्फर (S) है।
(ii) दिया गया तत्त्व चौथे आवर्त (n=4) में स्थित है। यह एक 4-ब्लॉक तत्त्व है क्योंकि d-उपकोश अपूर्ण है।
∴ वर्ग की संख्या = 2+ (n-1)d इलेक्ट्रॉनों की संख्या = 2+2=4
इस प्रकार यह तत्त्व चौथे आवर्त तथा समूह 4 में स्थित है। यह Ti (टाइटेनियम) है।
(iii) दिया गया तत्त्व छठवें आवर्त में स्थित है। यह एक f-ब्लॉक तत्त्व है क्योंकि विभेदी इलेक्ट्रॉन (n-2)f उपकक्ष में प्रवेश करता है। यह तत्त्व वर्ग 3 में स्थित है क्योंकि सभी f-ब्लॉक के तत्त्वों को तीसरे वर्ग में रखा गया है। यह तत्त्व Gd (gadolinium) है।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 31.
कुछ तत्वों की प्रथम ∆iH1 और द्वितीय ∆iH2 आयनन एन्थैल्पी (kJ mol-1 में) और इलेक्ट्रॉन लब्धि एन्थैल्पी (∆egH) (kJ mol-1 में) निम्नलिखित है-
(क) सबसे कम अभिक्रियाशील धातु है?
(ख) सबसे अधिक अभिक्रियाशील धातु है?
(ग) सबसे अधिक अभिक्रियाशील अधातु है?
(घ) सबसे कम अभिक्रियाशील अधातु है?
(ङ) ऐसी धातु है, जो स्थायी द्विअंगी हैलाइड (binary halide), जिनका सूत्र MX, (X= हैलोजेन) है, बनाता है।
(च) ऐसी धातु, जो मुख्यतः MX (X = हैलोजेन) वाले स्थायी सहसंयोजी हैलाइड बनाती है।
उत्तर
(क) तत्त्व V, क्योंकि इस प्रथम आयनन एन्थैल्पी का मान सर्वाधिक है तथा इलेक्ट्रॉन लब्धि एन्थैल्पी का मान धनात्मक है। यह कर्म क्रियाशील धातु है। यह एक उत्कृष्ट गैस होनी चाहिये।
(ख) तत्त्व II, क्योंकि इसकी प्रथम आयनन एन्थैल्पी का मान न्यूनतम तथा इलेक्ट्रॉन लब्धि एन्थैल्पी का मान कम है। इसे अधिक क्रियाशील धातु होना चाहिए। यह एक क्षारीय धातु होनी चाहिए।
(ग) तत्त्व III, क्योंकि इसकी इलेक्ट्रॉन लब्धि एन्थैल्पी का मान उच्च ऋणात्मक तथा प्रथम आयनन एन्थैल्पी का मान पर्याप्त उच्च है। यह एक हैलोजन (halogen) होना चाहिए।
(घ) तत्त्व IV, क्योंकि इसकी इलेक्ट्रॉन लब्धि एन्थैल्पी का मान उच्च ऋणात्मक तथा प्रथम आयनन एन्थैल्पी का मान काफी कम है। इसे सबसे कम क्रियाशील अधातु होना चाहिए। यह सम्भवतः एक ‘ कम क्रियाशील हैलोजन है।
(ङ) तत्त्व VI, क्योंकि इसकी प्रथम आयनन एन्थैल्पी का मान यद्यपि कम है, लेकिन फिर भी क्षार धातुओं से अधिक है। इसे एक मृदा क्षारीय धातु होना चाहिए। यह MX, प्रकार के द्विअंगी हैलाइड का निर्माण करेगा।
(च) तत्त्व I, क्योंकि इसकी प्रथम आयनन एन्थैल्पी का मान कम है लेकिन द्वितीय आयतन एन्थैल्पी का मान बहुत अधिक है। यह एक क्षारीय धातु है। यह Li होना चाहिए क्योंकि यह सूत्र MX का स्थायी सहसंयोजी हैलाइड बनाता है।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 32.
तत्वों के निम्नलिखित युग्मों के संयोजन से बने स्थायी द्विअंगी यौगिकों के सूत्रों की प्रगुक्ति कीजिए-
(क) लीथियम और ऑक्सीजन
(ख) मैग्नीशियम और नाइट्रोजन
(ग) ऐलुमिनियम और आयोडीन
(घ) सिलिकन और ऑक्सीजन
(ङ) फॉस्फोरस और फ्लुओरीन
(च) 71वाँ तत्व और फ्लुओरीन
उत्तर
(क) लीथियम की संयोजकता (201, वर्ग 1) 1 है, जबकि ऑक्सीजन (2s2 2p4, वर्ग 16) की 2 है। इसलिए, दोनों के मध्य बना द्विअंगी यौगिक Li20 है।
(ख) मैग्नीशियम (3s2, वर्ग 2) की संयोजकता 2 है, जबकि नाइट्रोजन (2s2 2p4, वर्ग 15) की
संयोजकता 3 है। इसलिये दोनों के मध्य बना द्विअंगी यौगिक Mg3N2 है।
(ग) ऐलुमिनियम (3s2 3p1, समूह 13) की संयोजकता 3 है, जबकि आयोडीन (5s2, 5p5, वर्ग 17) की संयोजकता 1 है। इसलिए, दोनों के मध्य बना द्विअंगी यौगिक AII3 है।
(घ) सिलिकॉन (3s2 3p2, वर्ग 14) की संयोजकता 4 है, जबकि ऑक्सीजन (2s2 2p4, वर्ग 17) की संयोजकता 2 है। इसलिए दोनों के मध्य बना द्विअंगी यौगिक SiO2 है।
(ङ) फॉस्फोरस (3s2 3p3, वर्ग 15) की संयोजकता 3 तथा 5 है, जबकि फ्लुओरीन (2s2 2p4, वर्ग 17) की संयोजकता 1 है। इसलिए, दोनों के मध्य बना द्विअंगी यौगिक PF3 अथवा PF5 है।
(च) तत्त्व जिसका परमाणु क्रमांक 71(4f14 5d1 6s2) है, एक लैन्थेनाइड है तथा ल्यूटीशियम : (Lu) है। यह वर्ग 3 में स्थित है। इसकी संयोजकता 3 है। फ्लु ओरीन (2s2 2p5, वर्ग 17) की संयोजकता 1 है। इसलिए, दोनों के मध्य बना द्विअंगी यौगिक LuF, है।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 33.
आधुनिक आवर्त सारणी में आवर्त निम्नलिखित में से किसको व्यक्त करता है?
(क) परमाणु संख्या
(ख) परमाणु द्रव्यमान
(ग) मुख्य क्वाण्टम संख्या
(घ) दिगंशी क्वाण्टम संख्या
उत्तर
(ग) मुख्य क्वाण्टम संख्या
आधुनिक आवर्त सारणी में, प्रत्येक आवर्त एक नवीन कक्ष के भरने के साथ प्रारम्भ होता है।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 34.
आधुनिक आवर्त सारणी के लिए निम्नलिखित के सन्दर्भ में कौन-सा कथन सही नहीं है।
(क) p-ब्लॉक में 6 स्तम्भ हैं, क्योंकि p-कोश के सभी कक्षक भरने के लिए अधिकतम 6 इलेक्ट्रॉनों की आवश्यकता होती है।
(ख) d-ब्लॉक में 8 स्तम्भ हैं, क्योंकि d-उपकोश के कक्षक भरने के लिए अधिकतम 8 इलेक्ट्रॉनों की आवश्यकता होती है।
(ग) प्रत्येक ब्लॉक में स्तम्भों की संख्या उस उपकोश में भरे जा सकने वाले इलेक्ट्रॉनों की संख्या के बराबर होती है।
(घ) तत्व के इलेक्ट्रॉन विन्यास को भरते समय अन्तिम भरे जाने वाले इलेक्ट्रॉन को उपकोश उसके दिगंशी क्वाण्टम संख्या को प्रदर्शित करता है।
उत्तर
कथन (ख) असत्य है। 4-ब्लॉक में 10 स्तम्भ हैं क्योंकि एक d-उपकक्ष में अधिकतम 10 इलेक्ट्रॉन ही व्यवस्थित हो सकते हैं।
प्रश्न 35.
ऐसा कारक, जो संयोजकता इलेक्ट्रॉन को प्रभावित करता है, उस तत्व की रासायनिक , प्रवृत्ति भी प्रभावित करता है। निम्नलिखित में से कौन-सा कारक संयोजकता कोश को
प्रभावित नहीं करता?
(क) संयोजक मुख्य क्वाण्टम संख्या (n)
(ख) नाभिकीय आवेश (z)
(ग) नाभिकीय द्रव्यमान
(घ) क्रोड इलेक्ट्रॉनों की संख्या
उत्तर
(ग) नाभिकीय द्रव्यमान। नाभिकीय द्रव्यमान संयोजकता कोश को प्रभावित नहीं करता है।
प्रश्न 36.
समइलेक्ट्रॉनिक स्पीशीज F–, Ne और Na+ का आकार इनमें से किससे प्रभावित : होता है?
(क) नाभिकीय आवेश (Z)
(ख) मुख्य क्वाण्टम संख्या (n)
(ग) बाह्य कक्षकों में इलेक्ट्रॉन-इलेक्ट्रॉन अन्योन्यक्रिया
(घ) ऊपर दिए गए कारणों में से कोई भी नहीं, क्योंकि उनका आकार समान है।
उत्तर
(क) नाभिकीय आवेश। समइलेक्ट्रॉनिक आयनों की त्रिज्या नाभिकीय आवेश के बढ़ने पर घटती है। दी गई समइलेक्ट्रॉनिक स्पीशीज में विभिन्न नाभिकीय आवेश हैं और इस प्रकार उनके आकार भिन्न हैं। इनका आकार निम्न क्रम में घटता है-
F– (+9)> Ne(+10)> Na+ (+11)
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
प्रश्न 37.
आयनन एन्थैल्पी के सन्दर्भ में निम्नलिखित में से कौन-सा असत्य/गलत है?
(क) प्रत्येक उत्तरोत्तर इलेक्ट्रॉन से आयनन एन्थैल्पी बढ़ती है।
(ख) क्रोड उत्कृष्ट गैस के विन्यास से जब इलेक्ट्रॉन को निकाला जाता है, तब आयनन एन्थैल्पी का मान अत्यधिक होता है।
(ग) आयनन एन्थैल्पी के मान में अत्यधिक तीव्र वृद्धि संयोजकता इलेक्ट्रॉनों के विलोपन को व्यक्त करती है।
(घ) कम मान वाले कक्षकों से अधिक n मान वाले कक्षकों की तुलना में इलेक्ट्रॉनों को आसानी से निकाला जा सकता है।
उत्तर
कथन (घ) असत्य है। अधिक » मान वाले कक्षकों से इलेक्ट्रॉनों को आसानी से निकाला जा सकता है, क्योंकि निकलने वाला इलेक्ट्रॉन नाभिक से दूर होता है।
प्रश्न 38.
B, AI, Mg, K तत्वों के लिए धात्विक अभिलक्षण का सही क्रम इनमें कौन-सा है?
(क) B > Al> Mg > K
(ख) Al> Mg > B > K
(ग) Mg > Al> K > B
(घ) K > Mg > Al> B
उत्तर
(घ) K> Mg> Al> B
यह क्रम इसलिए सही है क्योंकि धात्विक गुण आवर्त में आगे बढ़ने पर घटता है। इसलिए, Al, Mg तथा K के धात्विक गुण इस क्रम में होंगे-K > Mg > Al। इसके अतिरिक्त धात्विक गुण एक वर्ग में नीचे जाने पर बढ़ते हैं। अत: B को Al की तुलना में कम धात्विक होना चाहिए।
प्रश्न 39.
तत्वों B, C, N, F और Si के लिए अधातु अभिलक्षण का इनमें से सही क्रम कौन-सा है?
(क) B > C> Si> N > F
(ख) Si> C> B > N > F
(ग) F> N > C> B > Si
(घ) F > N > C > Si > B
उत्तर
(ग) F > N >C>B> Si
यह इसलिए है क्योकि अधातु अभिलक्षण एक आवर्त में बायें से । दायें ओर जाने पर बढ़ते हैं तथा वर्ग में नीचे जाने पर घटते हैं।
प्रश्न 40.
तत्वों F, CI, O और N तथा ऑक्सीकरण गुणधर्मों के आधार पर उनकी रासायनिक अभिक्रियाशीलता का क्रम निम्नलिखित में से कौन-से तत्वों में है?
(क) F > Cl> O > N
(ख) F> O> Cl> N
(ग) Cl> F> O > N
(घ) O> F> N > Cl
उत्तर
(ख) F>O>Cl>N
तत्त्वों का ऑक्सीकारक गुणधर्म एक आवर्त में बायें से दायें चलने पर बढ़ता है तथा वर्ग में नीचे जाने पर घटता है। ऑक्सीजन Cl की तुलना में एक प्रबल ऑक्सीकारक पदार्थ है क्योंकि 0 अधिक विद्युत ऋणात्मक है।
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता - RDS TEAM
Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता
Class 11 Chemistry Chapter 3
Class 11
तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता
RDS TEAM












.png)


0 Comments